Risikoklassifizierung von Medizinprodukten
Medizinprodukte und In-vitro-Diagnostika werden in verschiedene Risikoklassen eingeteilt, wobei unterschiedliche Klassenbezeichnungen verwendet werden. Das Hauptziel dieser Klassifizierung besteht darin, das Risiko für Anwender und Dritte im Zusammenhang mit jedem Produkt zu definieren. Die verschiedenen Klassifizierungssysteme legen spezifische Anforderungen für das Inverkehrbringen und die Überwachung nach dem Verkauf fest.
Die Bestimmung der Risikoklasse Ihres Medizinprodukts ist einer der ersten Schritte, die Sie bei der Konzeption und Entwicklung eines neuen Produkts für den EU-Markt beachten müssen. Je nach Risikoklasse Ihres Produkts müssen unterschiedliche Nachweise erbracht werden, um die CE-Kennzeichnung zu erhalten und Ihr Produkt erfolgreich auf den Markt zu bringen.
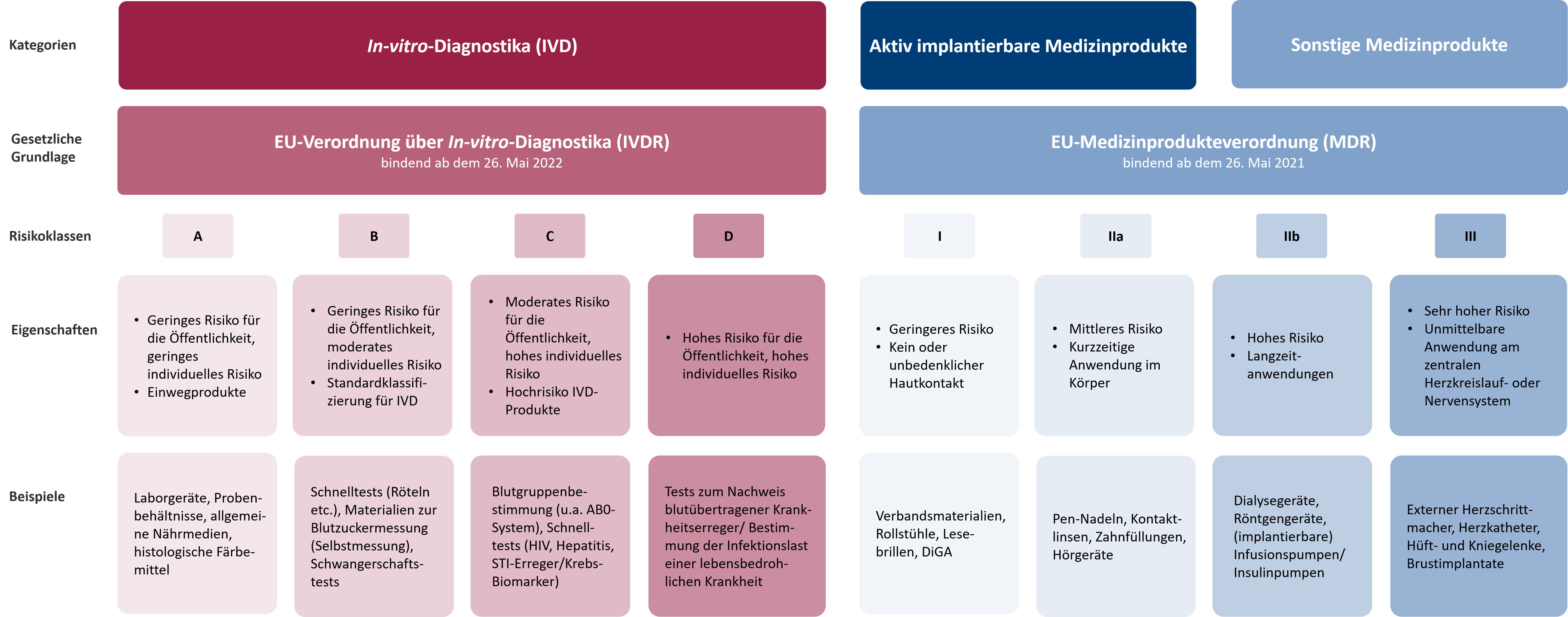
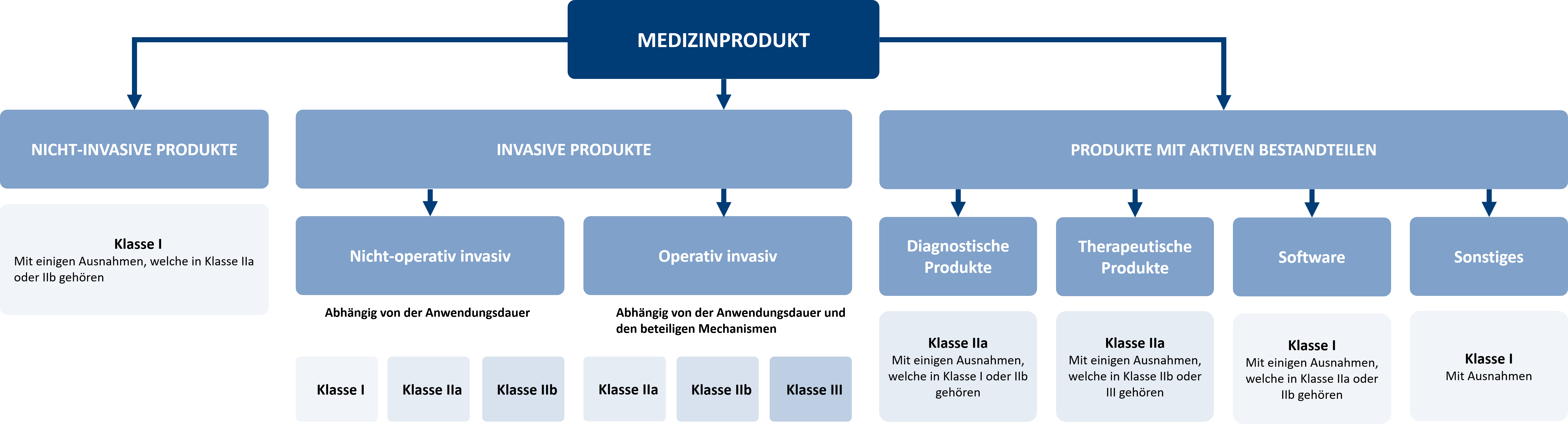
Klassifizierung von Medizinprodukten gemäß MDR (EU) 2017/745
Aktiv implantierbare Medizinprodukte, DiGA und andere Medizinprodukte werden in vier verschiedene Risikoklassen eingeteilt: Klasse I, Klasse IIa, Klasse IIb und Klasse III, wobei die Klasse III das höchste Risiko aufweist.
Die vorherige EU-Richtlinie enthielt bereits eine Risikoklassifizierung von Medizinprodukten. Diese wurde im Rahmen der neuen MDR-Verordnung aktualisiert und an mehreren Stellen geändert. Daher ist es für Hersteller eines bereits zertifizierten Medizinprodukts notwendig, die aktuelle Risikoklasse ihres Produkts zu überprüfen, gegebenenfalls anzupassen und eventuell fehlende klinische Daten schnellstmöglich nachzureichen.
In der neuen MDR finden Sie die Regeln zur Risikoklassifizierung in Anhang 8. Die Bestimmung der richtigen Risikoklasse kann jedoch aufgrund zahlreicher und komplexer Details schwierig sein. Aus diesem Grund haben wir einen Leitfaden zur Klassifizierung entwickelt, der Sie bei der Bestimmung der Klasse Ihres Produkts unterstützt.
Klassifizierung von In-vitro-Diagnostika gemäß IVDR (EU) 2017/746
Entgegen der vorherigen Einteilung in die Listen A und B erfolgt gemäß IVDR nun die Klassifizierung von In-vitro-Diagnostika in die Klassen A, B, C oder D. Dieses Klassifizierungsverfahren basiert hauptsächlich auf der Zweckbestimmung der Produkte und den damit verbundenen Risiken.
Im Folgenden sind alle Klassifizierungsregeln gemäß IVDR aufgeführt. Sollten für dasselbe Produkt mehrere Bestimmungen gelten, empfehlen wir im Zweifelsfall stets die Wahl der höheren Risikoklasse.

Benötigen Sie weitere Unterstützung?
Kontaktieren Sie uns dazu unter info@mic-mainz.de oder +49 6131 17-9646!
